A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, ontem, o registro de mais dois autotestes para covid-19. Um deles é o primeiro a detectar a infecção pelo novo coronavírus a partir de uma amostra de saliva do paciente, em vez de secreção do nariz. Ao todo, quatro autotestes obtiveram o registro aprovado pelo órgão e já podem ser vendidos no Brasil. Mas os consumidores só devem encontrar os exames nas gôndolas das farmácias na próxima semana.
Essa é a previsão feita pela primeira empresa que obteve o registro do autoteste de covid-19 no Brasil, a CPMH Comércio e Indústria de Produtos Médicos-Hospitalares e Odontológicos. Com sede em Brasília, no Setor de Indústria e Abastecimento (SIA), a CPMH indicou que o primeiro lote dos autotestes estará disponível para a população brasileira somente na próxima semana. O lote inicial previsto para farmácias, lojas de artigos médicos e respectivos e-commerces é composto por 20 milhões de unidades de exames.
A empresa atende a todo Brasil e informou que a quantidade dos próximos lotes ainda está sendo definida com as farmácias. A CPMH Produtos Hospitalares não indicou uma estimativa de preço que será cobrado pelo produto. “Ainda não há uma expectativa oficial sobre o preço dos autotestes, produzidos pela empresa chinesa Bioscience (Tianjin) Diagnostic Technology Co.,Ltd”, disse em comunicado. O preço final depende da política comercial das farmácias e lojas que irão realizar a venda.
Quem também prevê autotestes disponíveis para os consumidores no início de março é a empresa Eco Diagnóstica. O fabricante teve aprovado o registro de dois autotestes. Um deles é o exame que utiliza a saliva para detectar a infecção, aprovado ontem pela Anvisa. A coleta do material requer que o usuário deposite a saliva em um copo. O kit possui o item para que a pessoa produza a quantidade certa de secreção bucal para o exame.
O outro autoteste da Eco Diagnóstica aprovado pela agência reguladora utiliza o swab (cotonete) nasal, mais comum entre os exames realizados pelo próprio paciente. Os dois tipos serão produzidos no Brasil, e o que coleta a amostra nasal já teve a produção iniciada na quarta (23), na fábrica em Corinto (MG).
Ontem, a Anvisa aprovou o autoexame da empresa Kovalent do Brasil. O kit também será produzido em território nacional e estará disponível nas farmácias em versões com um, dois e cinco testes em uma mesma embalagem. O primeiro registro de autoteste foi concedido pela Anvisa na última semana, em 17 de fevereiro.
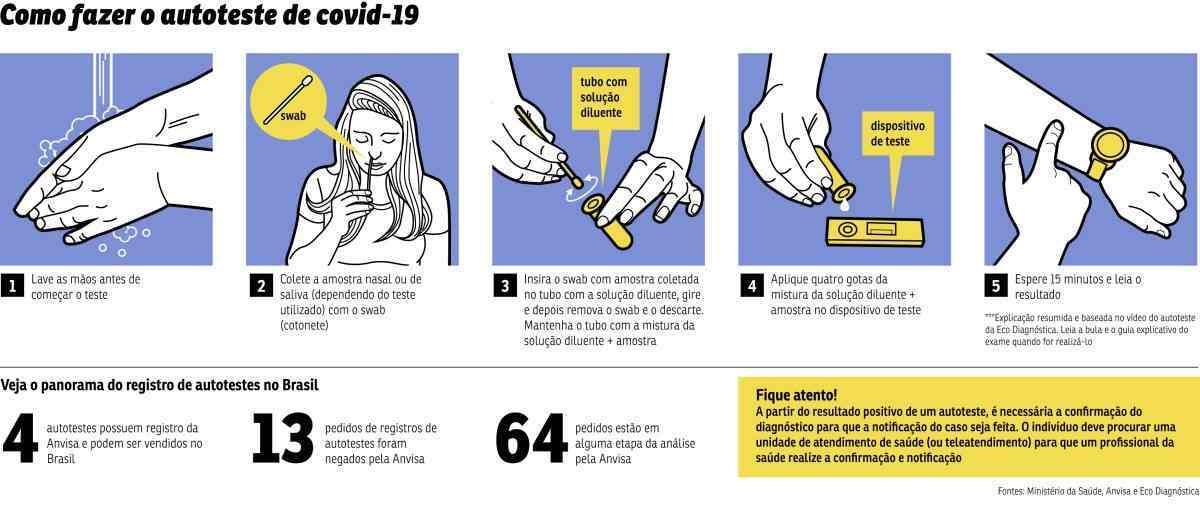
O aval do registro ocorreu 20 dias após a diretoria colegiada da agência aprovar, por unanimidade, a venda desse tipo de exame no Brasil, atendendo o pedido feito pelo Ministério da Saúde. Atualmente, 81 pedidos de registro desse tipo de exame já foram feitos à Anvisa, que reprovou 13 solicitações.
Ministro na ONU
O ministro da Saúde, Marcelo Queiroga, voltou a falar, ontem, na doação de vacinas contra a covid-19 por parte do Brasil. Em discurso na Assembleia Geral da Organização das Nações Unidas (ONU), o ministro reiterou o apoio do Brasil ao acesso justo e igualitário às vacinas contra a covid-19 e ressaltou ainda que, este ano, o país terá oportunidade de doar um número maior de vacinas do que o ofertado no ano passado.
“Reiteramos o compromisso do Brasil com o acesso justo e equitativo às vacinas contra a covid-19. Nesse sentido, já doamos mais de 5,6 milhões de doses em ações bilaterais e por meio da iniciativa Covax Facility. Ao longo de 2022, é possível aumentar esse número, em linha com a meta estabelecida pela Organização Mundial da Saúde (OMS)”, afirmou.
Nesta semana, Queiroga indicou que, com a produção de vacinas contra covid-19 em território nacional, já realizada pela Fundação Oswaldo Cruz (Fiocruz), o Brasil poderá exportar a vacina e ampliar o acesso global aos imunizantes. A Fiocruz já deu início ao processo de pré-qualificação para exportação da vacina covid-19 (recombinante) na OMS. Para ser exportada, a vacina produzida no Brasil precisa obter o registro emergencial perante a organização.
“Neste momento, a Fiocruz está dando início ao processo de pré-qualificação para exportação da vacina covid-19 (recombinante) na Organização Mundial de Saúde (OMS) e avaliando, junto à AstraZeneca e à Opas (Organização Pan-Americana da Saúde), a melhor estratégia para contribuir com o esforço global de vacinação contra a covid-19”, disse a fundação em nota.
Durante o discurso, Queiroga voltou a expressar a opinião contrária à obrigatoriedade da vacinação contra a covid-19, citando a liberdade dada aos cidadãos brasileiros como causa do sucesso da campanha de imunização no país. “O sucesso da Política Nacional de Imunizações, criada em 1976, decorre da forte cultura vacinal da população brasileira, que tem como princípio a liberdade que cada brasileiro tem de acessar as mais de 38 mil salas de vacinação do nosso país”, disse. Segundo o Ministério da Saúde, cerca de 70% da população do país está com o ciclo vacinal completo e 25% recebeu a dose de reforço.
Queiroga reforçou que uma das prioridades do governo brasileiro é o fortalecimento do complexo industrial da saúde. “O setor privado vem investindo em novas plantas no Brasil. Recentemente, a OMS selecionou o país como hub de desenvolvimento e produção de vacinas de plataforma RNA”, destacou. O ministro da Saúde permanece em agenda nos Estados Unidos até amanhã, quando deve retornar ao Brasil. Hoje, ele se encontra com o presidente e diretor executivo da Fundação de Pesquisa Cardiovascular da Universidade de Columbia, dr. Juan F. Granada.
Fonte: Correio Braziliense